Amyotrophe Lateralsklerose
Amyotrophe Lateralsklerose (ALS) ist eine spät auftretende, tödlich verlaufende Erkrankung der Motoneuronen (MND) mit einer Häufigkeit von etwa 1-5/100.000. Sie wurde erstmals 1869 von dem französischen Neurologen Jean-Martin Charcot beschrieben (Charcot-Krankheit) und wurde Ende 1930 bekannt, als bei dem Baseballspieler Lou Gehrig die Krankheit diagnostiziert wurde (Lou-Gehrig-Krankheit).
Die meisten ALS-Fälle treten sporadisch auf (SALS), aber 5-10 % der Fälle sind familiäre ALS (FALS) mit einer zugrunde liegenden genetischen Ursache. Typischerweise treten die Symptome bei SALS im Alter von etwa 60 Jahren und bei FALS im Alter von etwa 50 Jahren auf. Sowohl SALS als auch FALS werden durch eine fortschreitende Degeneration der kortikalen und spinalen Motoneuronen verursacht, die zu Lähmungen und schließlich zum Versagen der Atmung aufgrund von Muskelschwäche führen. Mutationen in zahlreichen Genen wurden mit Mechanismen in Verbindung gebracht, die eine neuronale Degeneration verursachen, wie z. B. eine RNA-Dysregulation, eine gestörte Proteinhomöostase oder die Bildung von zytoplasmatischen Aggregaten. Viele dieser genetischen Merkmale sind auch bei der eng verwandten Krankheit Frontotemporale Demenz (FTD) zu finden. Nicht-neuronale Zellen wie Astrozyten und Mikroglia verschlimmern die Neurodegeneration durch die Sekretion neurotoxischer Mediatoren und die Modulation der Expression von Glutamatrezeptoren. Funktionsstörungen von Oligodendrozyten und Schwann-Zellen führen zur Schädigung des Myelins.
Neben der genetischen Veranlagung wird angenommen, dass auch Umweltfaktoren zur Entstehung von ALS beitragen, da sich die Krankheit typischerweise im Erwachsenenalter manifestiert. Zu den vermuteten Risikofaktoren gehören unter anderem Rauchen, Kopftrauma, sportliche Veranlagung und neurotoxische Chemikalien, z. B. b-N-Methylamino-L-Alanin (BMMA).
Bislang gibt es keine wirksame Behandlung für ALS. Die wichtigsten Optionen sind neuroprotektive Behandlung, symptomatische und unterstützende Behandlung sowie einige unbewiesene krankheitsmodifizierende Therapien wie Stammzellentransplantation und Gentherapie.
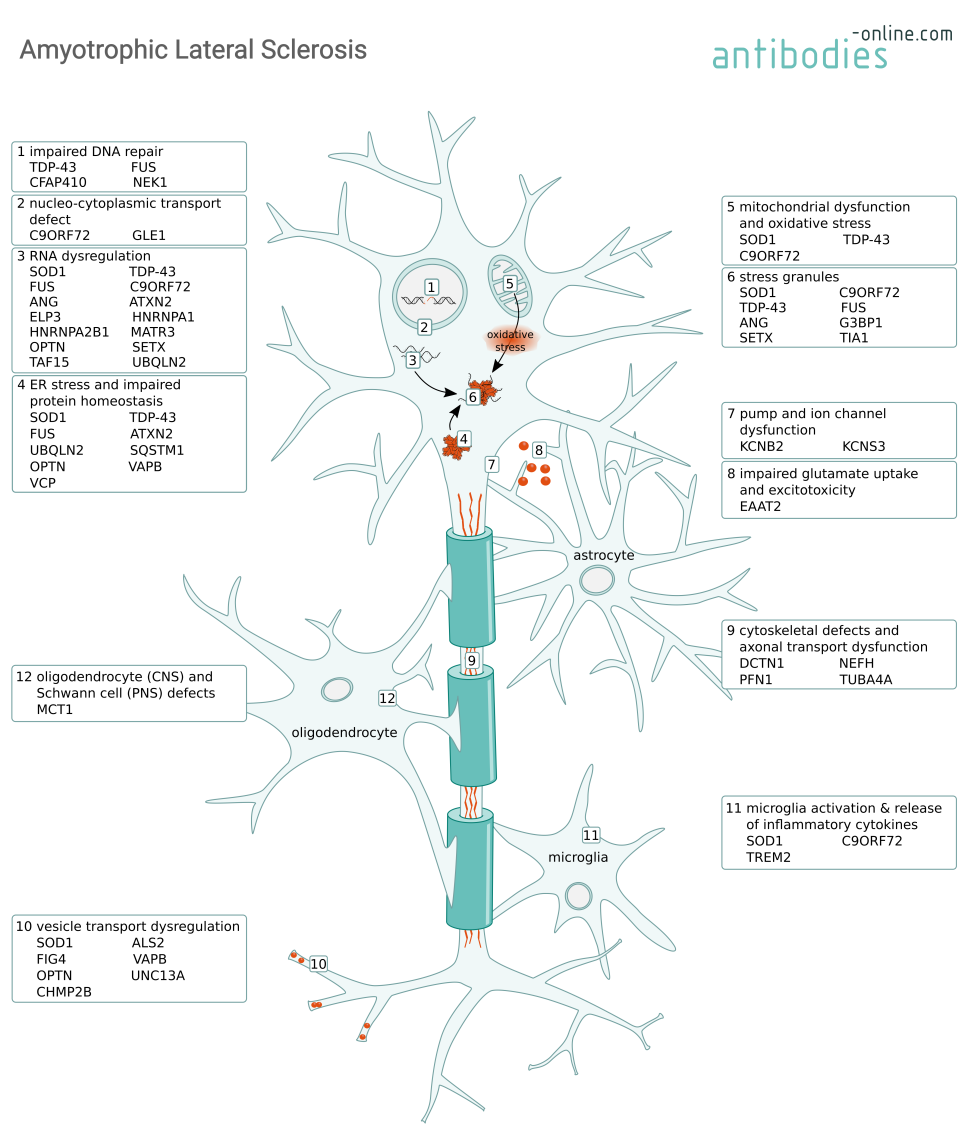
Mechanismen der Degeneration von Motoneuronen bei ALS und einige der beteiligten Proteine.
Wichtige Targets im Zusammenhang mit der Amyotrophen Lateralsklerose
Mehr als 140 Gene wurden identifiziert, die ALS verursachen, mit ihr in Verbindung stehen oder das Fortschreiten der Krankheit beeinflussen, darunter:
C9ORF72
C9ORF72 ist ein in Neuronen häufig vorkommendes Protein, das Teil des C9ORF7-SMCR-Proteinkomplexes ist. Man nimmt an, dass es eine Aktivität als Guanin-Nukleotid-Austauschfaktor hat, die Autophagie reguliert und eine Rolle beim endosomalen Transport spielt. Mutationen im C9orf72-Gen werden am häufigsten mit ALS in Verbindung gebracht (bis zu 50 % der FALS- und 10 % der SALS-Fälle).
Abhängig von den C9ORF72-Mutationen werden drei Mechanismen vermutet, die zur ALS-Pathologie beitragen. Erstens führt die Expansion eines GGGGCC-Repeats innerhalb des C9orf72-Promotors zu einer verminderten Proteinexpression und folglich zu einem Funktionsverlust. Zweitens führt die Anhäufung von GGGGCC-Repeat-haltigen RNA-Transkripten zur Bildung von toxischen RNA-Aggregaten, die weitere RNA-bindende Proteine sequestrieren und zu einer Dysregulation der Proteinhomöostase und der Bildung von Stressgranula führen. Und drittens kommt es zu einem toxischen Funktionsgewinn, wenn die GGGGCC-Hexanukleotidwiederholungen in Dipeptidwiederholungen (DPR) enthaltende Proteine übersetzt werden. Diese Poly-GA-, Poly-GP-, Poly-GR-, Poly-PA- und Poly-PR-Peptide (je nach Leseraster) bilden DPR-Einschlüsse, die den nukleozytoplasmatischen Transport beeinträchtigen und Neurodegeneration verursachen können. Diese vorgeschlagenen Mechanismen schließen sich nicht gegenseitig aus, und ihre jeweiligen Beiträge werden noch untersucht.
C9ORF72 Antibodies
SOD1
Genetische Studien haben Mutationen in der Superoxiddismutase (SOD1) als zweithäufigste Ursache für FALS mit einem Anteil von 10-20% identifiziert.
SOD1 ist ein hochexprimiertes, hauptsächlich zytosolisches Enzym, das die Umwandlung von Superoxid in Wasserstoffperoxid und Sauerstoff katalysiert. Mutiertes SOD1 bindet an Mitochondrien und beeinträchtigt die Atmung, indem es den Proteinimport blockiert. Dies führt zu oxidativem Stress, einem Ungleichgewicht in der zellulären Ca2+-Homöostase und der Bildung von intrazellulären Aggregaten und Stressgranula. Diese Aggregate führen zur Neurofilament-Aggregation und beeinträchtigen die axonalen Transportprozesse. Letztlich kann mutiertes SOD1 über die Hemmung von Bcl-2 Apoptose auslösen.
SOD1 Antibodies
TDP-43
Mutationen im TAR-DNA-bindenden Protein 43 kDa (TDP-43), das vom TARDBP-Gen kodiert wird, sind weniger häufig als die C9ORF72 DPR oder die SOD1-Mutationen. Seine Fehllokalisierung ins Zytoplasma ist jedoch ein charakteristisches Merkmal bei vielen ALS-Fällen.
TDP-43 ist ein essentielles DNA- und RNA-bindendes Kernprotein, das an der Regulierung der Transkription, der Modulation des Genspleißens, des RNA-Stoffwechsels und der Stressgranula beteiligt ist. Sowohl bei der familiären und sporadischen ALS als auch bei anderen neurodegenerativen Erkrankungen wie der eng verwandten Frontotemporalen Demenz (FTD) oder der Alzheimer-Krankheit (AD) sind mutierte TDP-43-Formen ein Hauptbestandteil der unlöslichen ubiquitinierten Proteinaggregate im Zytoplasma. Diese TDP-43-Aggregate sequestrieren miRNAs und Proteine und beeinträchtigen so die Proteinhomöostase. Die Dysregulation von kernkodierten mitochondrialen Proteinen führt zu mitochondrialer Dysfunktion und oxidativem Stress.
Die Ausschaltung von TDP-43 ist aufgrund der kritischen zellulären Funktion des Proteins kein praktikabler therapeutischer Ansatz. Es hat sich jedoch gezeigt, dass die Verringerung der Expression von Ataxin 2 (ATXN2) mit Hilfe von Antisense-Oligonukleotiden (ASOs) auch die TDP-43-Toxizität verringert.
TDP-43/TARDBP Antibodies
FUS
Ähnlich wie TDP-43 ist FUS (fused in sarcoma) ein RNA-bindendes Protein, das an der Transkription und RNA-Verarbeitung beteiligt ist. Im Einklang mit seiner Funktion befindet sich FUS in der Wildform im Zellkern. Bei ALS sind mutierte Formen des Proteins jedoch ins Zytoplasma fehllokalisiert. Hier können Funktionsgewinn-Mutationen zu einer Aggregation von FUS und assoziierten RNA-bindenden Proteinen führen, was ein Ungleichgewicht in der Proteinhomöostase, eine RNA-Dysregulation und die Bildung von Stressgranula zur Folge hat, die letztlich zum Verlust von Motoneuronen führen.
FUS-Mutationen liegen bei etwa 5 % der FALS- und weniger als 2 % der SALS-Fälle vor. Sie werden häufig mit früh einsetzender ALS in Verbindung gebracht. Aufgrund der dosisabhängigen toxischen Wirkung mutierter FUS-Varianten ist das Protein ein potenzielles therapeutisches Ziel für das Silencing durch Antisense-Oligonukleotide.
FUS Antibodies
Referenzen
- : "Ataxin-2 intermediate-length polyglutamine expansions are associated with increased risk for ALS." in: Nature, Vol. 466, Issue 7310, pp. 1069-75, (2010) (PubMed).
- : "A comprehensive review of amyotrophic lateral sclerosis." in: Surgical neurology international, Vol. 6, pp. 171, (2015) (PubMed).
- : "An amyotrophic lateral sclerosis-linked mutation in GLE1 alters the cellular pool of human Gle1 functional isoforms." in: Advances in biological regulation, Vol. 62, pp. 25-36, (2017) (PubMed).
- : "Decoding ALS: from genes to mechanism." in: Nature, Vol. 539, Issue 7628, pp. 197-206, (2016) (PubMed).
- : "Pathology of Neurodegenerative Diseases." in: Cold Spring Harbor perspectives in biology, Vol. 9, Issue 7, (2018) (PubMed).
- : "The Role of Dipeptide Repeats in C9ORF72-Related ALS-FTD." in: Frontiers in molecular neuroscience, Vol. 10, pp. 35, (2017) (PubMed).
- : "Therapeutic reduction of ataxin-2 extends lifespan and reduces pathology in TDP-43 mice." in: Nature, Vol. 544, Issue 7650, pp. 367-371, (2017) (PubMed).
- : "Dysregulated molecular pathways in amyotrophic lateral sclerosis-frontotemporal dementia spectrum disorder." in: The EMBO journal, Vol. 36, Issue 20, pp. 2931-2950, (2017) (PubMed).
- : "ALS Genes in the Genomic Era and their Implications for FTD." in: Trends in genetics : TIG, Vol. 34, Issue 6, pp. 404-423, (2019) (PubMed).
- : "Amyotrophic Lateral Sclerosis: An Update for 2018." in: Mayo Clinic proceedings, Vol. 93, Issue 11, pp. 1617-1628, (2019) (PubMed).
- : "RNA Dysregulation in Amyotrophic Lateral Sclerosis." in: Frontiers in genetics, Vol. 9, pp. 712, (2018) (PubMed).
- : "Impaired NHEJ repair in amyotrophic lateral sclerosis is associated with TDP-43 mutations." in: Molecular neurodegeneration, Vol. 15, Issue 1, pp. 51, (2021) (PubMed).
- : "Spatiotemporal Proteomic Analysis of Stress Granule Disassembly Using APEX Reveals Regulation by SUMOylation and Links to ALS Pathogenesis." in: Molecular cell, Vol. 80, Issue 5, pp. 876-891.e6, (2020) (PubMed).
- : "Stress Granule Dysregulation in Amyotrophic Lateral Sclerosis." in: Frontiers in cellular neuroscience, Vol. 14, pp. 598517, (2020) (PubMed).
- : "Improving clinical trial outcomes in amyotrophic lateral sclerosis." in: Nature reviews. Neurology, Vol. 17, Issue 2, pp. 104-118, (2021) (PubMed).
- : "TDP-43 aggregation induced by oxidative stress causes global mitochondrial imbalance in ALS." in: Nature structural & molecular biology, Vol. 28, Issue 2, pp. 132-142, (2021) (PubMed).
- : "Oligodendrocyte Dysfunction in Amyotrophic Lateral Sclerosis: Mechanisms and Therapeutic Perspectives." in: Cells, Vol. 10, Issue 3, (2021) (PubMed).
- : "Microglial TREM2 in amyotrophic lateral sclerosis." in: Developmental neurobiology, Vol. 82, Issue 1, pp. 125-137, (2022) (PubMed).
- : "TREM2 interacts with TDP-43 and mediates microglial neuroprotection against TDP-43-related neurodegeneration." in: Nature neuroscience, Vol. 25, Issue 1, pp. 26-38, (2022) (PubMed).
- : "Antisense oligonucleotide silencing of FUS expression as a therapeutic approach in amyotrophic lateral sclerosis." in: Nature medicine, Vol. 28, Issue 1, pp. 104-116, (2022) (PubMed).
- : "Apolipoprotein A1 Enhances Endothelial Cell Survival in an In Vitro Model of ALS." in: eNeuro, Vol. 9, Issue 4, (2022) (PubMed).

Goal-oriented, time line driven scientist, proficiently trained in different academic institutions in Germany, France and the USA. Experienced in the life sciences e-commerce environment with a focus on product development and customer relation management.
Mehr Informationen zum Autor



