Peptid Synthese - Methoden und Reagenzien
Julian PampelUnter Peptidsynthese versteht man in der organischen Chemie die Herstellung von Peptiden, bei der mehrere Aminosäuren über Peptidbindungen verknüpft werden. Im Gegensatz dazu wird der biologische Prozess der Herstellung langer Peptide (Proteine) gewöhnlich als Proteinbiosynthese bezeichnet.
Die Idee, Aminosäuren zu Ketten zu verknüpfen, ist über 100 Jahre alt, aber es dauerte etwa 50 weitere Jahre, um Lösungen für die auftretenden Probleme zu finden. Robert Bruce Merrifield pioneered the solid-phase peptide synthesis1.Mit SPPS ist es möglich, Peptide mit einer Länge von bis zu 50 Aminosäuren zu synthetisieren. Die Technologie ermöglicht die Synthese natürlicher Peptide, die in Bakterien nur schwer exprimiert werden können, den Einbau unnatürlicher Aminosäuren und die Erzeugung einzigartiger Peptide zur Optimierung einer gewünschten biologischen Reaktion oder anderer Ergebnisse.
Die Erfindung der Peptidsynthese führte zur Entwicklung verschiedener Anwendungsbereiche, in denen synthetische Peptide heute eingesetzt werden, darunter die Entwicklung epitopspezifischer Antikörper gegen pathogene Proteine, die Untersuchung von Proteinfunktionen sowie die Identifizierung und Charakterisierung von Proteinen. Synthetische Peptide ermöglichen die Erforschung wichtiger Zellsignalenzyme wie Kinasen und Proteasen, insbesondere zum Verständnis von Enzym-Substrat-Interaktionen. Schließlich werden synthetische Peptide auch als Standards und Reagenzien in der Massenspektrometrie (MS) eingesetzt. antibodies-online bietet eine Vielzahl von hochwertigen Blockierungspeptiden und Markierungspeptiden
Festphasen-Peptidsynthese SPPS
Um die SPPS zu starten, wird der C-Terminus der ersten Aminosäure an einen aktivierten festen Träger, in der Regel chemisch unreaktives Polystyrol, gekoppelt. Das Harz fungiert als C-terminale Schutzgruppe, das immobilisierte Protein kann während eines Filtrationsprozesses zurückgehalten werden, während Flüssigphasenreagenzien und Nebenprodukte der Synthese weggespült werden.
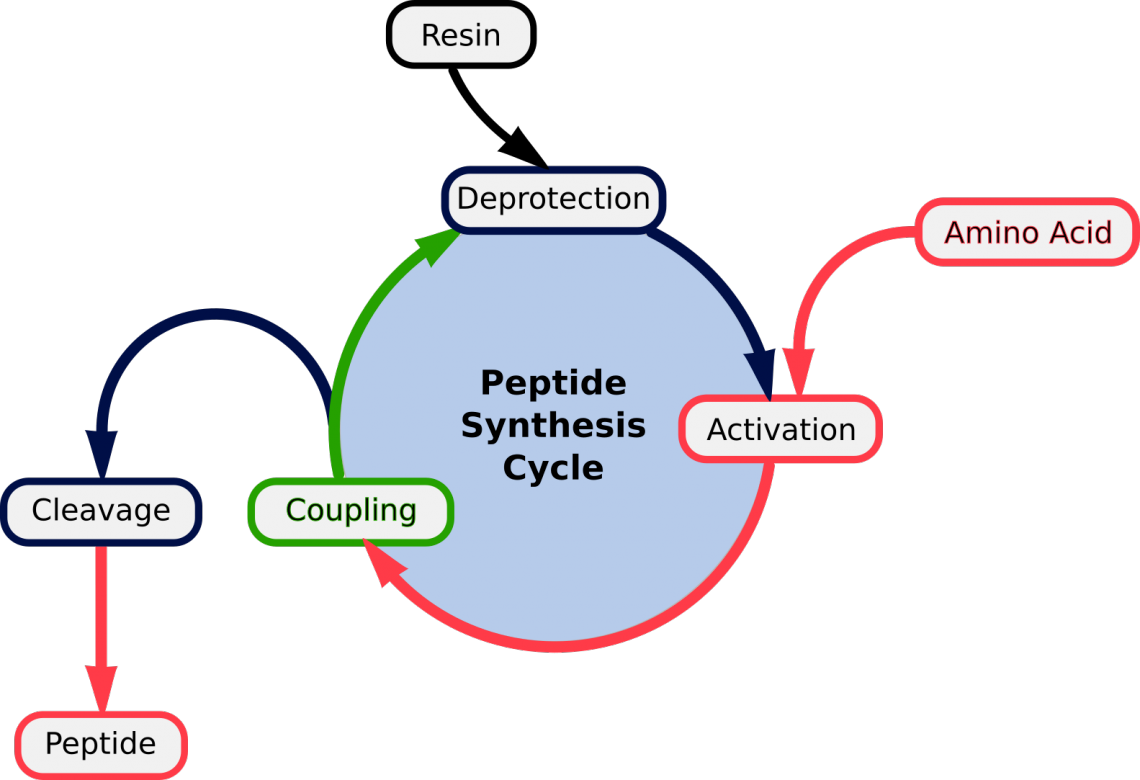
Figure 1. Repeated cycles of (1) Deprotection; (2) Activation of the aa; (3) Coupling | Detachment of mature peptide
Das allgemeine Prinzip von SPPS ist das der wiederholten Zyklen von Schutz-Waschschritt-Kopplung-Waschschritt (fig.1). Das freie N-terminale Amin eines in der Festphase gebundenen Peptids wird an eine einzelne N-geschützte Aminosäureeinheit gekoppelt (siehe unten). Diese Einheit wird dann entschützt, wobei ein neues N-terminales Amin zum Vorschein kommt, an das eine weitere Aminosäure gebunden werden kann.
Verbesserungen und Varianten
Im Laufe der Jahre wurden viele Varianten und Verbesserungen von SPPS entwickelt, wobei Chemikalien ausgetauscht wurden, um sie für eine bestimmte Anwendung zu optimieren.2. Verschiedene Harze lassen unterschiedliche funktionelle Gruppen am C-Terminus zu. Das Wang Resin und Oxymethylphenylacetamidomethyl (PAM)-Harz führt zu der herkömmlichen C-terminalen Carbonsäure3.Andererseits ergibt das Harz aus Rink-Amid und Paramethylbenzhydrylamin (pMBHA) ein C-terminales Amid, das zur Nachahmung des Inneren eines Proteins nützlich ist. Fmoc (Fluorenyl-9-methoxycarbonyl) ist ein Beispiel für eine basenlabile N α-Schutzgruppe. Die Vorteile sind gute Säurestabilität, Ultraviolettabsorption, die bei der Überwachung hilft, und eine einfache Herstellung. Zusätzlich müssen auch die Seitenketten geschützt werden, um die Bildung von verzweigten Ketten zu verhindern. Sie sollte permanent und mit dem Nα-Schutz kompatibel sein, sich aber nach Abschluss der Synthese leicht mit Säure entfernen lassen.
Funktions- und Schutzgruppen
| Functional group | Ser,Thr, Tyr | Asp, Glu | Lys | His | Cys |
| Protecting group | tert-Butylether | tert-Butylester | Boc | Boc / trityl | Trityl |
Figure 2. Functional and protecting groups in peptide synthesis.
Bei der Entfernung von Schutzgruppen, insbesondere unter sauren Bedingungen, entstehen kationische Spezies, die die funktionellen Gruppen der Peptidkette alkylieren können (Abb.2). Daher können während des Entschützungsschritts Scavenger wie Wasser, Anisol oder Thiolderivate im Überschuss zugegeben werden, um mit diesen freien reaktiven Spezies zu reagieren.
Produkte
Referenzen:
- : "Solid-phase peptide synthesis and solid-phase fragment coupling mediated by isonitriles." in: Proceedings of the National Academy of Sciences of the United States of America, Vol. 110, Issue 29, pp. 11708-13, (2013) (PubMed).
- : "Guide for resin and linker selection in solid-phase peptide synthesis." in: Current protocols in protein science, Vol. Chapter 18, pp. Unit 18.7, (2008) (PubMed).
- : "p-alkoxybenzyl alcohol resin and p-alkoxybenzyloxycarbonylhydrazide resin for solid phase synthesis of protected peptide fragments." in: Journal of the American Chemical Society, Vol. 95, Issue 4, pp. 1328-33, (1973) (PubMed).




