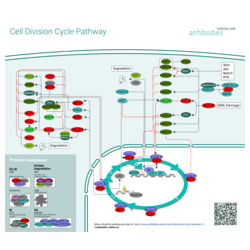
Zellzyklus
Alle Organismen (einzellige und mehrzellige) sind auf die Wiederholung von Wachstum und Teilung bestehender Zellen unter günstigen Bedingungen angewiesen. Während jeder Runde dieses Prozesses durchläuft die Zelle eine geordnete Reihe von Ereignissen, bei denen ihre genetische Information dupliziert und dann auf zwei Tochterzellen aufgeteilt wird. Diese Ereignisse sind streng reguliert und bestimmte Kontrollpunkte müssen passiert werden, damit der Zellzyklus abgeschlossen werden kann. Der Verlust der Kontrolle über diese Prozesse ist ein Kennzeichen von Krebs.
Der Zellzyklus ist in vier Hauptphasen unterteilt, die sich an den in der Zelle ablaufenden Ereignissen orientieren. In der ersten Gap-Phase (G1) werden die Proteine produziert, die für die DNA-Replikation notwendig sind. Die genetische Information wird dann während der Synthesephase (S) repliziert. In der zweiten Gap-Phase (G2) werden alle Komponenten hergestellt, die für die Auftrennung der verdoppelten DNA bei der anschließenden Mitose (M-Phase) notwendig sind. Zellen, die sich nicht aktiv teilen, befinden sich in der Ruhephase G0 in einem ruhenden Zustand.
Zellteilung ist lebensnotwendig, aber unkontrollierte Teilung ist gefährlich und kontraproduktiv. Daher hat die Zelle ein Interesse daran, eine strenge regulatorische Kontrolle darüber aufrechtzuerhalten, wie und wann die Teilung stattfindet. Es gibt zwei wichtige Kontrollpunkte im Zellzyklus. Der erste Choke-Point, den die Zelle passieren muss, liegt zwischen der G1- und S-Phase. Eine zweite Möglichkeit zur Arretierung besteht zwischen der G2- und der M-Phase. Sobald die DNA-Replikation eingeleitet wurde, muss sie beendet werden. Der wichtigste Kontrollpunkt im Zellzyklus ist daher der Restriktionspunkt (R-Punkt) zwischen G1- und S-Phase vor der DNA-Verdopplung, an dem der Zyklus in Abhängigkeit von mitogenen oder hemmenden Faktoren wie DNA-Schäden und Signalen aus verschiedenen Signalwegen fortschreitet.
Das Fortschreiten von einer Phase zur anderen wird durch Cyclin-abhängige Kinasen (CDK) und ihre Aktivatoren, die Cycline, gesteuert. Letztere sind instabil und ihre zelluläre Konzentration schwankt im Laufe des Zellzyklus. Dementsprechend bleiben spezifische Cyclin-CDK-Komplexe nach der Translation für eine sehr kurze Zeit in aktiver Form bestehen und werden dann abgebaut oder inaktiviert, wenn die jeweilige Phase des Zellzyklus abgeschlossen ist. Die Aktivierung spezifischer Cyclin-CDK-Komplexe ist charakteristisch für die verschiedenen Phasen des Zellzyklus und treibt die Produktion spezifischer Moleküle an, die mit dieser Phase der Teilung assoziiert und dafür notwendig sind. Zusätzliche Ebenen der dynamischen Kontrolle werden auch durch CDK-Inhibitoren bereitgestellt, die die CDK-Funktion auch in Anwesenheit ihres erforderlichen Cyclins blockieren.
References
- : "Unraveling Cell-Cycle Dynamics in Cancer." in: Cell systems, Vol. 2, Issue 1, pp. 8-10, (2018) (PubMed).
- : "Cell cycle development." in: Developmental cell, Vol. 6, Issue 3, pp. 321-7, (2004) (PubMed).
- : "The cell cycle, cancer development and therapy." in: Molecular biology reports, Vol. 49, Issue 11, pp. 10875-10883, (2022) (PubMed).
- : "Mammalian cell cycle cyclins." in: Seminars in cell & developmental biology, Vol. 107, pp. 28-35, (2021) (PubMed).
- : "The cell division cycle and the pathophysiology of Alzheimer's disease." in: Neuroscience, Vol. 87, Issue 4, pp. 731-9, (1998) (PubMed).