CD-Markerpanel
Martin HessCD ist eine Abkürzung für „Cluster of Differentiation”. CD-Moleküle sind Marker der Zelloberfläche, die bei der Identifizierung und Charakterisierung von Leukozyten und verschiedenen Leukozyten Subpopulationen sehr hilfreich sind. Die Arbeitsgemeinschaft über humane Leukozyten-Differenzierungsantigene HLDA (Human Leukocyte Differentiation Antigens), die im Jahr 1982 ihre Arbeit aufnahm, entwickelte die CD-Nomenklatur und führt seitdem die Liste der CD-Marker. Die ursprüngliche Idee hinter der CD-Nomenklatur war die Klassifikation vieler verschiedener monoklonaler Antikörper gegen Zelloberflächenmoleküle von Leukozyten, die in verschiedenen Laboratorien weltweit entwickelt worden waren. Die Anzahl der CD-Marker hat seitdem konstant zugenommen und wurde auf andere Zelltypen ausgeweitet. Heute gibt es mehr als 320 für den Menschen beschriebene CD-Cluster. Weitere Informationen und eine umfangreiche Liste der CD-Marker finden Sie unter www.hcdm.org.
CD-Marker sind besonders nützlich für die Identifizierung der Leukozyten-Population mittels Durchflusszytometrie. Eine kurze Einführung in die Durchflusszytometrie befindet sich auf unserer Referenzseite Durchflusszytometrie (FACS): Messprinzip & Aufbau. Der große Vorteil der Durchflusszytometrie besteht in der Möglichkeit, simultan verschiedene Marker auf einer einzigen Zelle zeitgleich nachzuweisen. Mit einem modernen Durchflusszytometer können ohne Probleme 8 bis 10 verschiedene Farben in einer Probe gemessen werden, wobei die fortschrittlichsten Zytometer sogar bis zu 18 Kanäle gleichzeitig messen können.
CD-Marker für Durchflusszytometrie
| Zelltype | Human | Maus | Ratte | Kuh | Pferd | Schwein | Hund | Affe/Primat |
| Leukocytes | ||||||||
| T-Cells (General) | ||||||||
| T-Helper Cells | ||||||||
| Cytotoxic T-Cells | ||||||||
| Natural Killer Cells | ||||||||
| B Cells | ||||||||
| Dendritic Cells | ||||||||
| Monocytes / Macrophages | ||||||||
| Granulocytes | ||||||||
| Hematopoetic Stem Cells | ||||||||
| Platelets | ||||||||
| Erythrocytes | ||||||||
| Endothelial Cells |
*(die Links in der Klammer geben an, dass nicht garantiert werden kann, dass die erwähnten Marker die besten definierenden Marker dieser Zellpopulation in der betreffenden Gattung sind)
Häufig verwendete CD Marker Antikörper
- (8)
- (5)
- (8)
- (4)
- (8)
- (3)
- (6)
- (3)
- (4)
- (3)
- (2)
- (10)
- (1)
- (7)
- (2)
- (2)
- (8)
- (1)
- (9)
- (4)
Verwendung von CD-Markern zur Bestimmung von Leukozyten-Populationen
Bei der Bestimmung bestimmter Leukozytenpopulationen mit dem Durchflusszytometer wird üblicherweise eine Kombination verschiedener CD-Marker zur Bestimmung einer Subpopulation verwendet, weil mit einem einzigen Marker üblicherweise keine gesamte Population definiert werden kann. In der Forschung werden bei der Bewertung von Experimenten mittels Durchflusszytometrie üblicherweise „Gating-Trees“ generiert.
Ein sehr anschauliches Beispiel ist die Verteilung von CD8. Obwohl CD8 der bedeutendste Marker und Namensgeber der CD8-positiven (CD8+) zytotoxischen T-Zellen ist, wird er auch von natürlichen Killerzellen (NK-Zellen) und dentritischen Zellen (DZ) exprimiert. Würden alle CD8-positiven Zellen aus der Leukozytenpopulation einer Blutprobe isoliert, dann würde die isolierte („gated“) Population aus CD8-positiven T-Zellen, NK-Zellen und DZ bestehen.
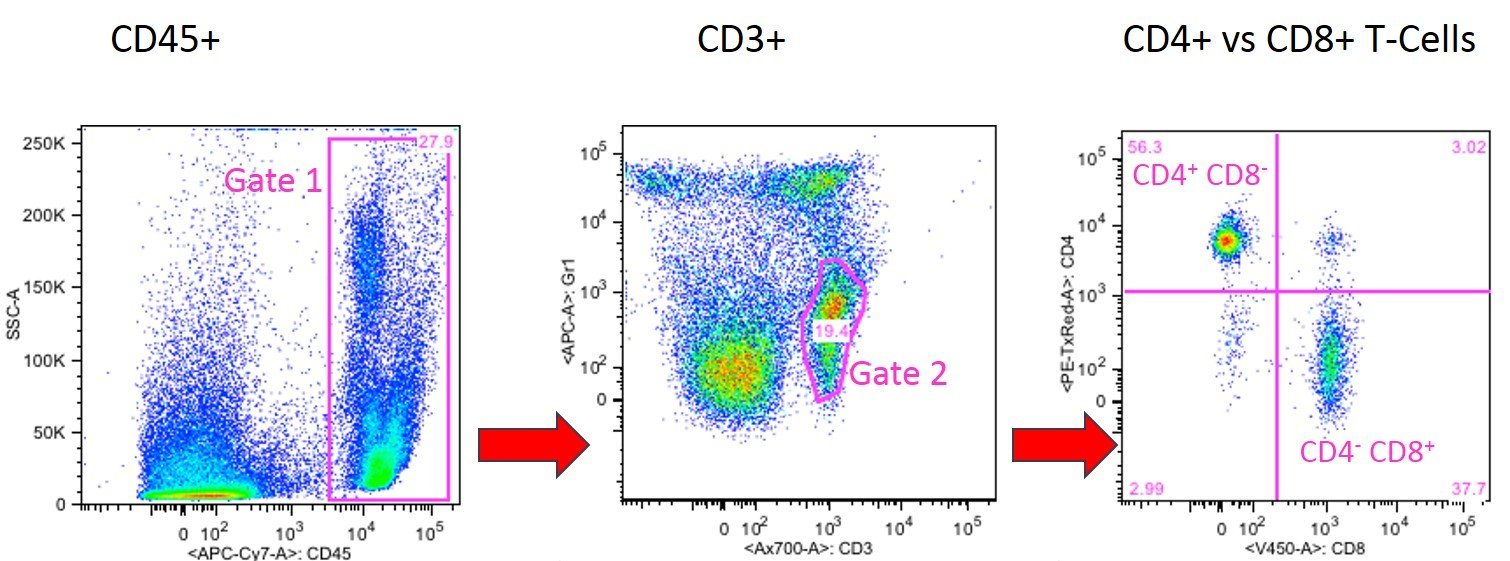
Im folgenden Experiment wurde das Verhältnis von CD4-positiven T-Helferzellen zu CD8-positiven zytotoxischen T-Zellen bestimmt. Zuerst wurden alle CD45-positiven Zellen (allgemeine Leukozyten-Marker) der Peripherblutprobe in ein Gate gefasst. (Gate 1).
Im nächsten Panel wurden alle CD45-positiven Zellen von Gate 1 auf ihre Expression von CD3 analysiert. CD3 ist der häufigste T-Zellmarker, der nur von T-Zellen und nicht von anderen CD8-positiven Zellen wie NK-Zellen oder DZ exprimiert wird. Durch Isolierung von CD3-positiven Zellen wird garantiert, dass keine CD3-negativen (z. B. NK-Zellen oder DZ), sondern nur CD3-positive Zellen als CD8-positive T-Zellen gezählt werden.
Die CD3-positive T-Zellpopulation kann weiter in zytotoxische CD8-positive T-Zellen und CD4-positive T-Helferzellen differenziert werden, wie dies in Panel 2 dargestellt ist, wo die CD3-positiven Zellen aus Gate 2 auf ihre Expression von CD4 und CD8 analysiert wurden. CD4-positive, CD8-negative T-Helferzellen befinden sich im oberen linken Quadranten und CD4-negative, CD8-positive zytotoxische T-Zellen sind im unteren rechten Quadranten von Panel 3 dargestellt.
Ein Forscher, der an verschiedenen T-Helferpopulationen wie TH1, TH2, TH9, TH17 und TReg interessiert ist, würde gegebenenfalls eine Anfärbung zur Untersuchung der jeweiligen zusätzlichen oder intrazellulären Marker dieser Subpopulationen durchführen.
CD-Marker - Einige wichtige Fragen und Antworten
Was sind CD-Cluster und wofür werden sie verwendet?
CD-Cluster (Cluster of Differentiation) sind Oberflächenmarkermoleküle, die auf Zellen vorkommen. Sie werden in der Immunologie verwendet, um verschiedene Zelltypen zu identifizieren und zu charakterisieren.
Welche CD-Cluster sind auf einer bestimmten Zellpopulation vorhanden?
Jeder Zelltyp besitzt ein bestimmtes Set an CD-Markern und lässt sich durch diese bestimmen. Zelltypen werden anhand ihrer spezifischen Ausstattung mit CD-Markern definiert. So tragen z.B. alle Leukozyten CD45. Zellen, die positiv für CD3 und CD8 sind, werden als cytotoxische T-Zellen bezeichnet. Auch unterschiedliche Entwicklungsstadien eines Zelltyps lassen sich anhand des spezifischen Sets an CD-Markern nachweisen. Die Identifizierung der CD-Cluster auf einer Zellpopulation erfordert den Einsatz von Techniken wie Durchflusszytometrie.
Wie verändert sich die Expression von CD-Clustern während der Entwicklung oder in bestimmten Krankheitszuständen?
Die Expression von CD-Clustern kann sich während der Entwicklung von Zellen verändern: Verändern sich krankheitsbedingt Zellen, so ändert sich auch das spezifische Set an CD-Markern, mit deren Hilfe Wissenschaftler die Zellveränderungen nachweisen können. Bestimmte Krankheitszustände können also Auswirkungen auf die Expression von CD-Clustern haben. Um solche Veränderungen zu untersuchen, können Wissenschaftler vergleichende Analysen zwischen verschiedenen Entwicklungsstadien oder Krankheitszuständen durchführen, z. B. durch den Vergleich von Gewebeproben oder Zellkulturen.
Welche Funktionen haben bestimmte CD-Cluster auf Zellen?
Die Funktionen von CD-Clustern auf Zellen können vielfältig sein. Einige CD-Cluster dienen als Rezeptoren für Liganden und können Signalwege aktivieren, die das Verhalten und die Funktion der Zellen beeinflussen. Andere CD-Cluster sind an der Zelladhäsion oder der Immunerkennung beteiligt.
Wie können wir die Expression von CD-Clustern quantifizieren?
Die Expression von CD-Clustern kann mit verschiedenen experimentellen Methoden quantifiziert werden. Eine häufig verwendete Methode ist die Durchflusszytometrie, bei der spezifische Antikörper verwendet werden, um die Expression von CD-Clustern auf einzelnen Zellen zu detektieren. Alternativ können auch Techniken wie die Einzelzell-RNA-Sequenzierung eingesetzt werden, um die Expression von CD-Clustern auf genomweiter Ebene zu analysieren.