Was ist Durchflusszytometrie (FACS)?
Martin Holschbach (updated by Eri Kinoshita & JP)Die Durchflusszytometrie, die ursprünglich in den späten 1960er Jahren entwickelt wurde, ist ein Verfahren zur quantitativen Bestimmung von Oberflächenmolekülen und intrazellulären Proteinen, Peptiden und DNA. Mit Hilfe von Licht Zellen in einem heterogenen Flüssigkeitsgemisch zählt und profiliert. Die Durchflusszytometrie ist eine besonders leistungsfähige Methode, da sie es einem Forscher ermöglicht, schnell, präzise und einfach Daten über viele Parameter aus einem heterogenen Flüssigkeitsgemisch mit lebenden Zellen zu sammeln.
Was ist Durchflusszytometrie?
Bei dem Begriff FACS handelt es sich um eine Abkürzung für Fluorescence Activated Cell Sorting. Obwohl der Begriff FACS ein Markenname der Firma Becton Dickinson (BD) ist, hat er sich als Synonym für die Durchflusszytometrie eingebürgert. Geräte und Zubehör für die Durchflusszytometrie werden auch unter anderen Namen von diversen Herstellern angeboten.
Anhand einer Durchflusszytometrie können große Populationen loser Zellen in einem flüssigen Medium schnell erfasst werden. In der Immunologie wird die Durchflusszytometrie beispielsweise eingesetzt, um verschiedene Immunzell-Subtypen aufgrund ihrer Größe und Morphologie zu identifizieren, zu trennen und zu charakterisieren.
Wenn zusätzliche Informationen benötigt werden, können Antikörper, die mit Fluoreszenzfarbstoffen markiert und gegen hochspezifische Zelloberflächenantigene (z.B. Cluster von Differenzierungs- oder CD-Markern) angehoben werden, verwendet werden, um spezifische Subpopulationen innerhalb einer größeren Gruppe besser zu identifizieren und zu isolieren.
In einem Durchflusszytometer:
- Die Probenzellen werden nacheinander durch einen engen Kanal geleitet.
- Mit Licht werden die Zellen im Kanal beleuchtet.
- Eine Reihe von Sensoren erfassen die Lichtarten, die von den Zellen gebrochen oder ausgestrahlt werden.
- Die von den Sensoren erfassten Daten werden gesammelt und integriert, um ein umfassendes Bild der Probe zu erhalten.
- (356)
- (11)
- (1)
- (270)
- (43)
- (16)
- (7)
- (1)
- (15)
- (5)
- (1)
- (14)
- (12)
- (1)
- (10)
- (15)
- (3)
- (13)
- (17)
- (1)
- (11)
- (15)
- (1)
- (4)
- (7)
- (1)
- (5)
- (9)
- (1)
Lichtsorten in einem Durchflusszytometrie-Experiment
Ein Durchflusszytometer verwendet gebrochenes oder emittiertes Licht, um Zellen zu zählen und zu identifizieren. Erfahren Sie mehr über Lichtbrechung in FACS-Experimenten in den folgenden Abbildungen.
Forward Scatter
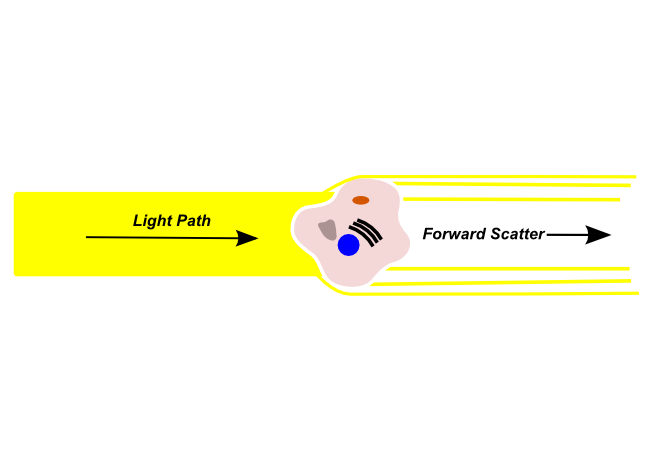
Forward Scatter
Die Zellen streuen einen Teil des Lichts, welches mittels Detektoren (Photomultiplier) nachgewiesen wird.
Die Menge des gestreuten Lichts korreliert mit der Größe der Zelle und mit ihrer Komplexität. So streuen Granulozyten, die eine raue Oberfläche und in ihrem Inneren viele Vesikel haben, deutlich mehr Licht als die sehr glatten B- oder T-Zellen. Das Vorwärtsstreulicht ist ein Maß für die Beugung des Lichts im flachen Winkel und hängt vom Volumen der Zelle ab.
Side Scatter
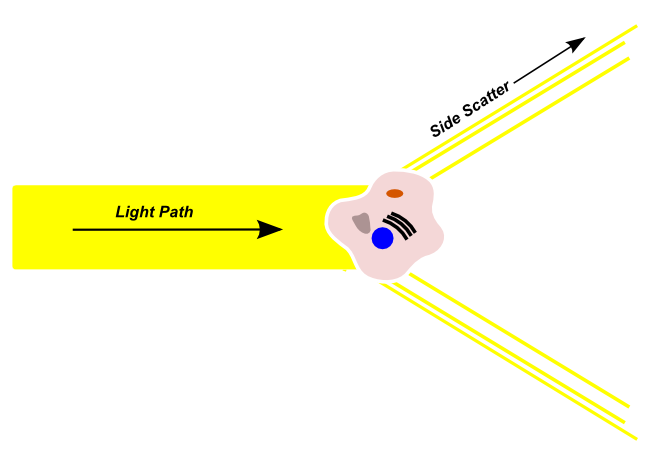
Side Scatter
Seitenstreulicht (SSC = Sidewards Scatter) gelangt von der Lichtquelle in den Strömungskanal, wird von Zellen in eine Richtung gebrochen, die außerhalb des ursprünglichen Lichtpfades liegt. Seitlich gestreutes Licht wird von einem Sensor erfasst, der orthogonal zum ursprünglichen Lichtweg verläuft.
Seitenstreulicht wird in der Regel verwendet, um die Granularität der Zelle, die Größe und Struktur ihres Zellkerns und die Menge der Vesikel in einer Zelle zu bestimmen. Hochgranulare Zellen mit einer großen Menge an interner Komplexität, wie Neutrophilen, erzeugen mehr seitlich gestreutes Licht und ein höheres Seitenstreusignal als Zellen mit einer geringen Granularität und Komplexität.
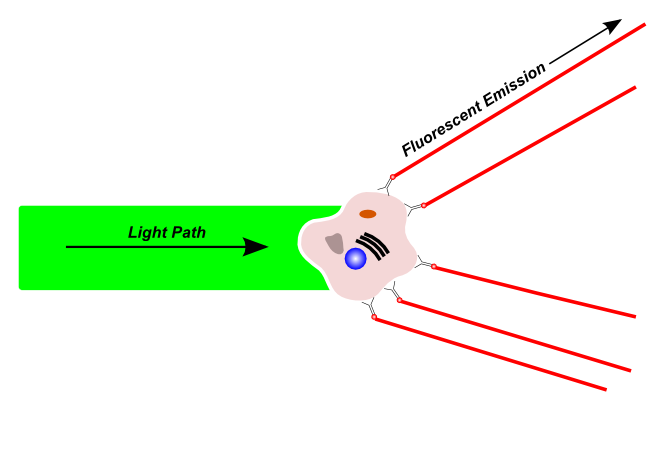
Fluorescence Emission
Fluoreszenz-Emission
Fluoreszierendes Licht wird von fluoreszierenden Molekülen nach Anregung durch einen kompatiblen Wellenlängenlaser emittiert. Fluoreszierendes Licht kann von natürlich fluoreszierenden Materialien in der Zelle stammen, oder von Fluoreszenzfarbstoffen oder fluoreszenzmarkierten Antikörpern, die zur Markierung einer bestimmten Struktur auf der Zelle verwendet wurden. Setzt man z.B. die Farbstoffe DAPI und Propidiumiodid ein, welche in die DNA einer Zelle interkalieren (d.h. sich zwischen die Basen einlagern), so kann man anhand der Helligkeit der Zelle untersuchen, wieviel DNA sie enthält.
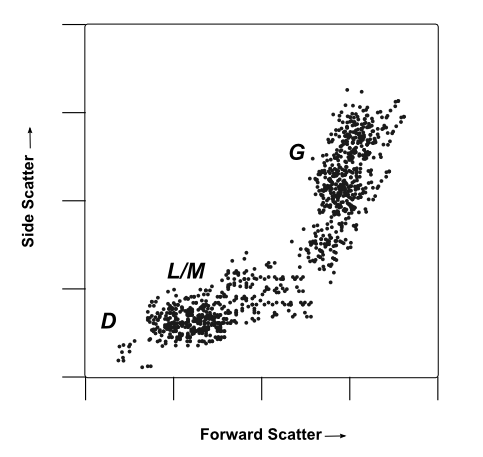
Multiparameter Analyse
Multiparameter Analyse
Ein Schein-Durchflusszytometrie-Punktdiagramm, das vorwärts und seitlich von einer Leukozytenpopulation gestreut dargestellt wird. Zellpopulationen sind durch ihre wahrscheinliche Identität gekennzeichnet:
D Trümmer, sehr kleine Gegenstände mit geringer Vorwärts- und Seitenstreuung.
L/M Wahrscheinlich Leukozyten/Monozyten, kleine bis mittlere Zellen mit geringer interner Komplexität/Granularität. Diese Zellen erzeugen eine mittlere Vorwärtsstreuung und eine geringe Signalintensität der Seitenstreuung.
G Vermutlich Granulozyten, große Zellen mit hoher interner Komplexität/Granularität. Diese Zellen erzeugen hohe Vorwärts- und Seitenstreusignale.
Während einige Identitäten durch Vorwärts- und Seitenstreuprofile bestätigt werden können, bietet die Markierung mit einem zelltypspezifischen Marker immer eine höhere Auflösung und Sicherheit bei der Profilierung komplexer heterogener Zellpopulationen.
So kann beispielsweise in der obigen Darstellung ein Forscher in der Lage sein, Granulozyten und Lymphozyten mit vorwärts- und seitwärts gestreutem Licht zu unterscheiden. Allerdings sind drei Granulozytenklassen (Neutrophilen, Basophilen und Eosinophilen) in Größe und Struktur sehr ähnlich und verleihen ihnen ähnliche lichtstreuende Eigenschaften. In diesem Fall könnten Neutrophile selektiv aufgrund ihrer Expression einen neutrophile-spezifischen Marker wie z.B. ELANE.
FACS: Datengestützte Zellsortierung
Die Begriffe Durchflusszytometrie und fluoreszenzaktivierte Zellsortierung (FACS) werden oft austauschbar verwendet. In der Praxis gibt es Unterschiede zwischen den beiden Methoden.
FACS ist ein Weiterentwicklung der Durchflusszytometrie, die ein außergewöhnliches Maß an Funktionalität bietet. Mit Hilfe von FACS kann ein Forscher physisch eine heterogene Zellmischung in verschiedene Populationen sortieren.
Durch die Verwendung hochspezifischer Antikörper, die mit Fluoreszenzfarbstoffen markiert sind, kann ein Forscher eine FACS-Analyse durchführen und gleichzeitig Daten sammeln und eine Probe nach einer nahezu unbegrenzten Anzahl verschiedener Parameter sortieren.
In einem FACS Experiment:
- Es werden Vorwärtsstreu-, Seitenstreu- und Fluoreszenzdaten gesammelt, wie in der konventionellen Durchflusszytometrie.
- Benutzerdefinierte Parameter geben Auskunft darüber, wie Zellen sortiert werden sollen.
- Basierend auf diesen Parametern verwendet die FACS-Maschine eine Elektrode, um eine elektrische Ladung auf jede Zelle aufzubringen.
- Beim Verlassen der Strömungskammer sortieren Elektromagnete die Zellen durch Ladung in separate Behälter.
Wie sehen die Daten der Durchflusszytometrie aus?
In einem Durchflusszytometrie-Experiment wird jede Zelle, die das Durchflusszytometer durchläuft und erkannt wird, als eigenes Ereignis klassifiziert.
Zusätzlich wird jeder Lichtart, die vom Durchflusszytometer erfasst wird (Vorwärtsstreuung, Seitenstreuung und jede Wellenlänge der Fluoreszenzemission), ein eigener Kanal zugeordnet. Die Daten der Durchflusszytometrie zeichnen jedes Ereignis unabhängig voneinander auf und stellen die Signalintensität des in jedem Kanal erfassten Lichts für jedes Ereignis dar.
Durchflusszytometrie-Daten werden typischerweise auf eine von zwei Arten dargestellt: Histogramme, die nur einen einzelnen Parameter messen oder vergleichen, und Dotplots, die 2 oder 3 Parameter gleichzeitig auf einem zwei- oder dreidimensionalen Streudiagramm vergleichen.
Ein Histogramm zeichnet typischerweise die in einem einzigen Kanal erfasste Intensität entlang einer Achse auf und die Anzahl der bei dieser Intensität erfassten Ereignisse liegt in einer separaten Achse. Eine große Anzahl von Ereignissen, die mit einer bestimmten Intensität erfasst wurden, wird als Spitze auf dem Histogramm angezeigt.
Im Gegensatz dazu wird in einem Punktdiagramm jedes Ereignis als ein einzelner Punkt auf einem Streudiagramm dargestellt. Die Intensität von 2 verschiedenen Kanälen (oder 3 verschiedenen Kanälen in einer dreidimensionalen Darstellung) wird entlang der verschiedenen Achsen dargestellt. Veranstaltungen mit ähnlichen Intensitäten werden sich in der gleichen Region auf dem Streudiagramm zusammenfinden.
Note: In Dot-Plot-Daten führen große Stichproben oft zu einem starken Cluster von Ereignissen, die im gleichen Bereich der Darstellung dargestellt werden. Es gibt viele Methoden, um diesen Regionen eine zusätzliche Auflösung hinzuzufügen. So kann beispielsweise eine Heatmap, wie im obigen Beispiel, verwendet werden, um Informationen über die Ereignisdichte in einem bestimmten Bereich des Grundstücks zu liefern.
Histogramme und Dotplots bieten unterschiedliche Vorteile für die Datenanalyse der Durchflusszytometrie. Die Wahl der optimalen Darstellung Ihrer Daten kann dazu beitragen, dass eine vollständige Geschichte in einem einfachen, verständlichen Format erzählt wird.
Histogramme
- Sind schnell zu lesen und leicht zu verstehen.
- Sind am nützlichsten, wenn nur ein Parameter (z.B. Intensität eines einzelnen Fluoreszenzkanals) wichtig ist.
- Die übliche Darstellung beinhaltet die Intensität eines einzelnen Kanals (horizontale Achse) gegenüber der Anzahl der erfassten Ereignisse (vertikale Achse).
- Mehrfach überlagerte Histogramme können verwendet werden, um einen einzelnen Parameter aus zwei verschiedenen Probenpopulationen (z.B. experimentell vs. Kontrolle) zu vergleichen.
Dot-plots
- Sind am nützlichsten, wenn Sie multiparametrische Daten vergleichen müssen (z.B. Intensität der Seitenstreuung vs. Vorwärtsstreuung).
- Kann zwei- oder dreidimensionale sein.
- Die Intensität jedes Kanals wird auf einer eigenen Achse dargestellt.
- Jedes eindeutige Ereignis wird an einem einzigen Punkt dargestellt.
- Sind eine komplexere, anschaulichere Darstellung von Daten.
Dotplots und Histogramme schließen sich nicht gegenseitig aus, und die komplexesten Durchflusszytometrie-Experimente nutzen mehrere Plots, um reichhaltige, multiparametrische Daten auf einer Probe anzuzeigen.
In vielen Fällen müssen mehr als drei Parameter gleichzeitig dargestellt werden. In diesem Fall kann eine Datenanalyse-Technik, die als „Gating“ bekannt ist, helfen, zusätzliche Auflösung und Flexibilität zu erreichen, indem sie die Analyse einer nahezu unbegrenzten Anzahl von Parametern gleichzeitig über mehrere verschiedene Streudiagramme und Histogramme ermöglicht.
Gating erhöht die Auflösung der Daten FACS-Daten
Kurz gesagt, ist Gating eine Methode zur Auswahl von Zellen aus einem Durchflusszytometrie-Experiment, die Sie genauer analysieren möchten. Gating ermöglicht es einem Forscher, mehr Informationen über eine Teilgesamtheit von Zellen zu sammeln und anzuzeigen, als normalerweise auf einem 2- oder 3-dimensionalen Punktdiagramm angezeigt werden könnten.
Gating erhöht die Auflösung eines Durchflusszytometrie-Experiments und ermöglicht die gleichzeitige Analyse einer nahezu unbegrenzten Anzahl verschiedener Parameter (Kanäle).
In einem Gated Flow Zytometrie Experiment:
- Ein Benutzer sammelt Daten der Durchflusszytometrie von einem oder mehreren Kanälen auf einem Punktdiagramm.
- Basierend auf den erfassten Daten zeichnet der Benutzer eine Gate-Box, die eine Teilgesamtheit von Zellen zur weiteren Analyse auswählt.
- Die Subpopulation von Zellen innerhalb des Gates wird speziell auf anderen Plots hervorgehoben, die Informationen aus alternativen Kanälen anzeigen.
Gates bieten eine unglaubliche Flexibilität bei der Durchflusszytometrie und ermöglichen eine Auflösung bis zu Einzelzellen für jeden Kanal, der dem Forscher zur Verfügung steht. Mehrere Gates können für einen einzelnen Scatter-Plot eingerichtet werden, und Gates können "gestapelt" und kombiniert werden (d.h. Eine Subpopulation von Zellen, die in den Kanälen 1 und 2 angesteuert werden, kann für die Kanäle 3 und 4 weiter angesteuert werden, um eine spezifischere und tiefere Analyse zu ermöglichen).
Ein Beispiel für Gating
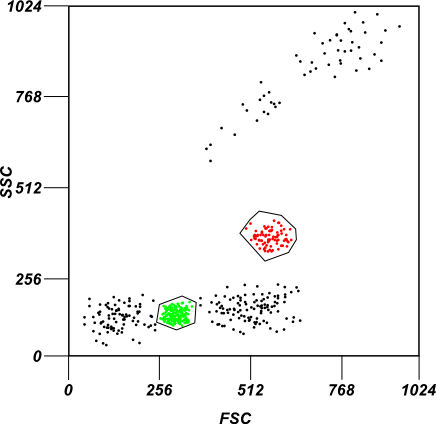
Ein simples Beispiel für Gating. Im Bild werden zwei Subpopulationen von Zellen basierend auf der Intensität ihrer Forward und Side-scatter Profile ausgewählt.

Die gleiche Zellpopulation wird durch ein kohärentes Farbschema hervorgehoben, wenn zwei verschiedene Kanäle analysiert werden, die die Fluoreszenzintensität im obigen Bild messen.
Ein Hinweis zur Kompensation
Spillover von einem Kanal auf einen anderen kann zu falschen als positiv identifizierten Signalen führen. Spillover ist das Artefakt, das ein Fluoreszenzfarbstoff im Kanal eines anderen Fluorophors in Abhängigkeit von seiner relativen Helligkeit und seinem Emissionsspektrum verursachen kann. Hier kommt die Kompensation ins Spiel. Die Kompensation ist ein Verfahren, das das Signal eines bestimmten Kanals von den anderen Kanälen, die im gleichen Experiment verwendet werden, isoliert. FITC hat z.B. seine Emissionsspitze im grünen Bereich des elektromagnetischen Spektrums. Es fluoresziert aber auch im gelben Kanal, wo PE Licht emittiert. Einfach ausgedrückt, subtrahiert die Kompensation das FITC-Signal vom PE-Kanal.
Dieses Signal im "falschen" Kanal wird vom Signal abgezogen, welches durch den zu untersuchenden Fluorophor verursacht wird. In der obigen Probe ist das Verhältnis der grünen und der gelben Komponente bei einer gegebenen Anregungswellenlänge für FITC konstant. Somit ist es möglich, aus der Messung im grünen Kanal mit Hilfe der konstanten Kompensationskoeffizienten die Menge des unspezifischen gelben FITC-Signals im PE-Kanal abzuleiten. Das Gleiche gilt für den Spillover aus dem PE in den FITC-Kanal.
FACS und Durchflusszytometrie: Häufig gestellte Fragen
Im Folgenden finden Sie einige Fragen und Antworten, die im Zusammenhang mit FACS und Durchflusszytometrie häufig gestellt werden.
Was ist Durchflusszytometrie und wie funktioniert sie?
Die Durchflusszytometrie ist eine Technik zur Analyse und Sortierung einzelner Zellen oder Partikel auf der Grundlage ihrer physikalischen und chemischen Eigenschaften. Bei dieser Methode werden die Zellen in einem Flüssigkeitsstrom suspendiert und durch einen Laserstrahl geleitet. Das gestreute und emittierte Licht wird dann von einer Reihe von Sensoren erfasst, und die daraus resultierenden Daten werden von einem Computer ausgewertet. Die Durchflusszytometrie ist eine Methode, die eine schnelle Analyse einer einzelnen Zelle oder eines Partikels ermöglicht, während diese einen oder mehrere Laser durchlaufen, während sie in gepuffertem Salz suspendiert sind. Die Partikel wurden sowohl auf sichtbare als auch auf Fluoreszenzstreuung gemessen.
Wie funktioniert die Durchflusszytometrie?
Das Verfahren der Durchflusszytometrie umfasst die folgenden Schritte:
- Vorbereitung der Probe: Zunächst wird die Probe für die Analyse vorbereitet. Bei der Probe kann es sich um eine Suspension von Zellen oder Partikeln in einem flüssigen Medium handeln, z. B. Blut oder Gewebekulturmedium.
- Zellfärbung: Um verschiedene Zelltypen zu identifizieren und zu differenzieren, werden die Zellen häufig mit fluoreszierenden Farbstoffen oder Antikörpern angefärbt, die an bestimmte Moleküle auf der Zelloberfläche binden. Auf diese Weise können Forscher bestimmte Zellpopulationen identifizieren und sortieren.
- Durchflusszelle: Die gefärbte Probe wird dann in eine Durchflusszelle injiziert, wo sie zu einem schmalen Strom fokussiert wird, der den Laserstrahl durchläuft.
- Laser: Der Laserstrahl wird verwendet, um die fluoreszierenden Moleküle auf den Zellen anzuregen, so dass sie Licht in bestimmten Wellenlängen aussenden.
- Lichtdetektion: Das emittierte Licht wird von einer Reihe von Photomultipliern erfasst, die die Intensität des emittierten Lichts bei verschiedenen Wellenlängen messen.
- Datenanalyse: Die gewonnenen Daten werden von einem Computer verarbeitet, der ein Histogramm der Fluoreszenzsignalintensität für jede Zelle in der Probe erstellt. Dies ermöglicht es den Forschern, verschiedene Zellpopulationen anhand ihrer physikalischen und chemischen Eigenschaften zu identifizieren und zu quantifizieren.
- Zellsortierung: Wenn das Durchflusszytometer mit einem Zellsortierer ausgestattet ist, können damit einzelne Zellen anhand ihrer Fluoreszenzeigenschaften physisch getrennt werden. Die sortierten Zellen können dann für weitere Analysen oder Kulturen gesammelt werden.
Wie lange dauert eine durchflusszytometrische Analyse?
Die Dauer einer Durchflusszytometrie-Analyse kann von verschiedenen Faktoren abhängen, z. B. von der Komplexität der Probe, der Anzahl der zu analysierenden Zellen und dem verwendeten Gerät. Im Allgemeinen kann die Analyse einer einzelnen Probe jedoch zwischen einigen Minuten und einigen Stunden dauern. Bei komplexeren Proben oder solchen mit einer großen Anzahl von Zellen kann die Analyse länger dauern. Außerdem kann die Zellsortierung zusätzliche Zeit in Anspruch nehmen.
Was ist FACS in der Durchflusszytometrie?
FACS steht für Fluoreszenz-aktivierte Zellsortierung und ist eine Technik, die in der Durchflusszytometrie verwendet wird, um Zellen auf der Grundlage ihrer Fluoreszenzeigenschaften physisch zu trennen. Bei der FACS werden die Zellen zunächst mit Fluoreszenzfarbstoffen oder Antikörpern angefärbt, die an bestimmte Moleküle auf der Zelloberfläche binden. Die gefärbten Zellen werden dann durch eine Durchflusszelle geleitet, wo sie von einem Laserstrahl beleuchtet werden. Während die Zellen den Laser durchlaufen, wird ihre Fluoreszenz von einem Computer in Echtzeit erfasst und analysiert. Anhand der Fluoreszenzeigenschaften werden die Zellen sortiert und in verschiedene Sammelröhrchen oder Platten aufgeteilt. FACS ist ein wertvolles Instrument in vielen Forschungsbereichen, darunter Immunologie, Stammzellenforschung und Krebsforschung, da es die Isolierung bestimmter Zellpopulationen für weitere Untersuchungen oder Analysen ermöglicht.
Was sind die Ergebnisse der Durchflusszytometrie?
Die Ergebnisse der Durchflusszytometrie-Analyse können Informationen über die physikalischen und chemischen Eigenschaften der einzelnen Zellen oder Partikel in einer Probe liefern. Die vom Gerät erzeugten Daten enthalten Informationen über die Größe, Form, Komplexität und Fluoreszenzintensität jeder Zelle oder jedes Partikels in der Probe. Diese Daten werden in der Regel als eine Reihe von Histogrammen, Punktdiagrammen oder anderen grafischen Darstellungen präsentiert, die es den Forschern ermöglichen, die Merkmale der verschiedenen Zellpopulationen in der Probe zu visualisieren und zu analysieren. Die Durchflusszytometrie kann auch dazu verwendet werden, den Prozentsatz der Zellen zu quantifizieren, die bestimmte Oberflächenmarker oder intrazelluläre Moleküle exprimieren, was einen Einblick in den Funktionsstatus verschiedener Zellpopulationen ermöglicht.
Wie kann die Durchflusszytometrie bei der Analyse der Zellproliferation helfen?
Die Analyse der Zellproliferation mittels Durchflusszytometrie ist eine häufig verwendete Technik zur Messung des Wachstums und der Teilung von Zellen. Sie basiert auf der Messung des DNA-Gehalts einzelner Zellen, während sie den Zellzyklus durchlaufen. Durch die Analyse des DNA-Gehalts einer Zellpopulation können Forscher den Prozentsatz der Zellen in jeder Phase des Zellzyklus bestimmen und die Zellvermehrungsrate berechnen. Diese Informationen sind in vielen Forschungsbereichen von entscheidender Bedeutung, z. B. in der Krebsbiologie, der Arzneimittelforschung und der Toxikologie, da sie Einblicke in die dem Zellwachstum und der Zellteilung zugrunde liegenden Mechanismen geben.
Kann die Durchflusszytometrie die Proteinexpression nachweisen?
Mit der Durchflusszytometrie kann die Proteinexpression indirekt durch die Verwendung fluoreszenzmarkierter Antikörper nachgewiesen werden, die sich spezifisch an das betreffende Protein binden. Durch Anfärben der Zellen mit fluoreszierend markierten Antikörpern können Forscher die Häufigkeit und Verteilung des Proteins innerhalb einer Zellpopulation messen. Diese Technik wird als Immunfluoreszenz bezeichnet und ist in der Durchflusszytometrie weit verbreitet, um die Expression von Zelloberflächen- und intrazellulären Proteinen zu analysieren. Die Analyse der Proteinexpression mittels Durchflusszytometrie ist ein leistungsfähiges Instrument in vielen Forschungsbereichen, darunter Immunologie, Krebsbiologie und Arzneimittelforschung.




